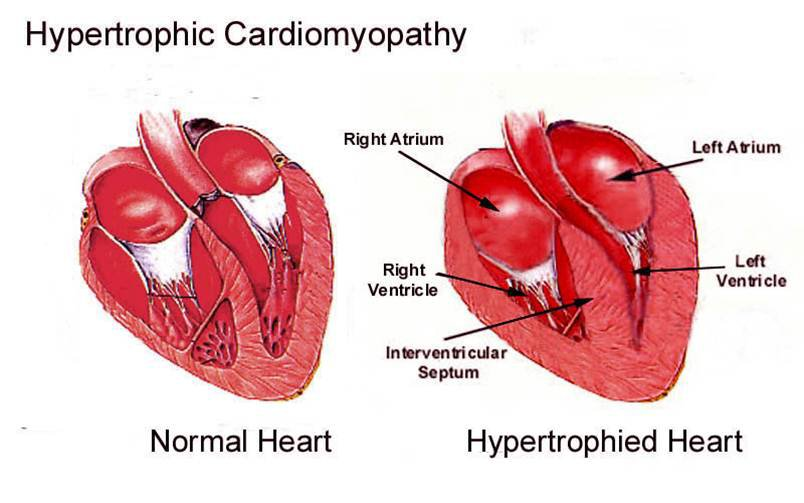
La cardiomiopatia ipertrofica è definita da un aumento dello spessore della parete ventricolare sinistra, non spiegabile da altre condizioni patologiche. Si distinguono forme familiari/genetiche e forme non familiari/non genetiche.
Indice
- 1 Cardiomiopatia ipertrofica, cause ed epidemiologia
- 2 Cardiomiopatia Ipertrofica, la diagnosi
- 3 Cardiomiopatia ipertrofica, sintomi e segni da non trascurare
- 4 Esami utili per una corretta diagnosi
- 5 Terapia medica e complicanze da evitare
- 6 Terapia invasiva nelle forme ostruttive (LVOT)
- 7 Quali rischi corre un paziente con diagnosi di cardiomiopatia ipertrofica ?
- 8 Follow-Up
Cardiomiopatia ipertrofica, cause ed epidemiologia
Nel 60% dei casi, la cardiomiopatia ipertrofica è determinata da mutazioni a carico di geni che codificano per proteine sarcomeriche, a trasmissione autosomica dominante.
Nel 5-10% è determinata da altri disturbi genetici, tra cui malattie ereditarie metaboliche, mitocondriale e neuromuscolari, cromosomopatie e sindromi genetiche.
In altri casi è determinata da patologie acquisite, mentre nel restante 25-30% l’etiologia resta sconosciuta.
Cardiomiopatia Ipertrofica, la diagnosi
Come eseguire una giusta diagnosi? Questa si basa sul riscontro di un aumento dello spessore della parete ventricolare sinistra tramite qualsiasi metodica di imaging (Eco, RM, TC).
Altre caratteristiche della cardiomiopatia ipertrofica comprendono la presenza di fibrosi, alterazioni a carico della valvola mitrale, disfunzione del microcircolo e alterazioni ecgrafiche.
Cardiomiopatia ipertrofica, sintomi e segni da non trascurare
L’età è una caratteristica importante. Le malattie metaboliche o altre sindromi genetiche vanno sospettate in età neonatale, mentre ad esempio l’amiloidosi TTR è tipica delle persone anziane.
Inoltre è utile ricostruire il pedigree per 3-4 generazioni per confermare un’origine genetica ed identificare altri membri della famiglia che sono a rischio.
Molti pazienti sono completamente asintomatici; e spesso possono sviluppare sintomi molti anni dopo la comparsa di segni all’ECG o all’ecocardiogramma.
Nei neonati i sintomi e i segni di insufficienza cardiaca includono tachipnea, cattiva alimentazione, sudorazione eccessiva e mancata crescita. I bambini, gli adolescenti e gli adulti si lamentano di astenia e dispnea, dolore toracico, palpitazioni e sincope.

Allo stesso modo anche l’esame obiettivo può essere negativo; in presenza di ostruzione alla fuoriuscita di sangue dalla camera cardiaca di sinistra, può essere presente un soffio sistolico e nei casi più avanzati possono essere presenti i segni dello scompenso cardiaco.
Esami utili per una corretta diagnosi
Elettrocardiogramma o ECG
L’ECG raramente risulta completamente negativo (solo 6%), risultando in questo modo un esame molto sensibile per la presenza di segni di ipertrofia, onde Q patologiche e/o alterazioni del recupero come lo slivellamento ST ed l’inversione onde T. L’ECG Holter fino a 48h è indicato per la ricerca di aritmie più complesse.
Ecocardiogramma
Rappresenta la metodica fondamentale per la diagnosi di Cardiomiopatia ipertrofica.
Ci aiuta nel determinare: lo spessore della parete ventricolare, valutare l’ostruzione a riposo e da sforzo, lo studio della contrattilità cardiaca.
Risonanza Magnetica o RM
La Risonanza Magnetica cardiaca restituisce informazioni dettagliate sulla morfologia cardiaca, sulla funzione ventricolare e sulla caratterizzazione tissutale. È più sensibile dell’eco per l’individuazione di ipertrofia apicale, aneurismi e trombi.
Scintigrafia ossea
Scintigrafia ossea con 99mTc-DPD dovrebbe essere considerata nel sospetto di amiloidosi TTR (età > 65 anni, storia di S. del Tunnel Carpale bilaterale, caratteristiche ecgrafiche ed ecografiche).
Biopsia Endomiocardica
Non fa parte del routinario protocollo diagnostico, ma può svolgere un ruolo se si sospetta infiltrazione miocardica.
Esami di Laboratorio
Una batteria di prima linea comprende: emocromo, funzione renale, funzionalità epatica, LDH, CPK, Troponine, proBNP, pH, elettroliti, acido urico, funzione tiroidea. In seguito a valutazione specialistica ulteriori esami comprendono: lattati, piruvato, ammoniemia, chetoni, acidi grassi liberi, carnitina.
Diagnosi Differenziale
Alcune condizioni fisiologiche o patologiche possono determinare ipertrofia cardiaca e porre problematiche di diagnosi differenziale:
– Cuore da atleta
– Ipertensione arteriosa
– Ipertrofia settale isolata negli anziani
Test Genetico e Screening familiare
Nella maggior parte dei casi la Cardiomiopatia Ipertrofica è ereditata come tratto autosomica dominante con un 50% di rischio di trasmissione alla prole.
Alcuni casi sono spiegati da mutazioni de novo (di prima diagnosi), ma apparentemente casi sporadici possono derivare anche della penetrazione incompleta in un genitore e, meno comunemente, da trasmissione autosomica recessiva.
Quando una mutazione genetica causativa è identificata in un paziente, i suoi parenti dovrebbero essere testati geneticamente e poi valutati clinicamente se portatori della stessa mutazione.
Terapia medica e complicanze da evitare
La strategia terapeutica cambia in relazione alla presenza o meno di ostruzione all’efflusso sinistro ossia di ostacolo alla fuoriuscita di sangue dal ventricolo sinistro verso la periferia definita come cardiomiopatia ipertrofica ostruttiva.
I pazienti con tale ostruzione dovrebbero evitare la disidratazione e l’eccessivo consumo di alcol, mentre dovrebbe essere incoraggiata la perdita di peso.
I beta-bloccanti privi di attività vasodilatatrice, titolati fino alla massima dose tollerata, rappresentano la terapia di prima linea per il miglioramento dei sintomi.
Se i soli beta-bloccanti risultano inefficaci, si può aggiungere il disopiramide, titolandolo fino alla massima dose tollerata.
Sono stati dimostrati simili risultati per il Diltiazem che deve essere considerato nei pazienti, che sono intolleranti o hanno controindicazioni nei confronti dei beta-bloccanti e del verapamil.
Nifedipina e altri calcio antagonisti diidropiridinici, ed anche vasodilatatori venosi ed arteriosi, non sono raccomandati per il trattamento di pazienti con cardiomiopatia ipertrofica ostruttiva.
Terapia invasiva nelle forme ostruttive (LVOT)
Non esistono dati per supportare l’uso di procedure invasive per ridurre l’ostruzione del ventricolo sinistro in pazienti asintomatici, indipendentemente dalla gravità. Trattamento invasivo dovrebbe essere considerato nei pazienti concardiomiopatia ipertrofica ostruttiva con sintomi moderati-severi (NYHA funzionale III-IV) e/o sincope da sforzo ricorrente nonostante la terapia farmacologica massima tollerata.
Esistono due tipi di approccio: l’approccio chirurgico o l’ablazione alcolica del setto.
La procedura chirurgica più comunemente usata è la miectomia settale ventricolare (procedura Morrow). L’ablazione alcolica settale consiste nell’iniezione selettiva di alcool in una arteria settale perforante per creare una cicatrice settale localizzata. Nei centri esperti la procedura ha risultati simili alla chirurgia in termini di riduzione del gradiente, miglioramento dei sintomi e capacità di esercizio. La principale complicanza non fatale è il blocco AV nel 7-20% dei pazienti e la mortalità procedurale è simile alla miectomia.
Quali rischi corre un paziente con diagnosi di cardiomiopatia ipertrofica ?
Complessivamente la mortalità cardiovascolare negli adulti con Cardiomiopatia Ipertrofica (CMI o HCM) è del 1-2% all’anno. Le principali cause sono SCD (Sudden cardiac death o morte cardiaca improvvisa), scompenso e malattia trombo embolica. La stima del rischio SCD è parte integrante della gestione clinica. Caratteristiche cliniche associate ad un aumento del SCD comprendono: età, familiarità per morte improvvisa in giovane età, massimo spessore della parete Ventricolo sinistro, gradiente LVOT, dimensioni dell’atrio, pregressi episodi di tachicardia ventricolare non sostenuta, sincope, anormale risposta pressoria all’esercizio; tutti questi parametri sono impiegati per il calcolo del HCM Risk-SCD score.
Follow-Up
Una rivalutazione clinica con ECG ed ecocardiogramma va ripetuta ogni 1-2 anni in pazienti clinicamente stabili e ogni volta che vi sia un cambiamento nella sintomatologia del paziente. ECG Holter di 48h è indicato ogni 6-12 mesi. Risonanza Magnetica può essere considerata ogni 5 anni nei pazienti stabili e ogni 2-3 anni nei pazienti con progressione della malattia. Test da sforzo dovrebbe essere considerato ogni 2-3 anni nei pazienti stabili e ogni anno nei pazienti con progressione della patologia e per integrarlo può essere considerato il Test CardioPolmonare.
Contatta l’esperto in merito a questo argomento.
Dott. Augusto Esposito
Cardiologo
Dipartimento Cardiotoracico – U.O.C. Cardiologia diagnostica ed interventistica. Ospedale del Cuore – G.Pasquinucci. Massa (Toscana). Dipartimento di Scienze Mediche Traslazionali
CCMR Regione Campania
AORN Monaldi Napoli.