Indice
Scompenso cardiaco: di cosa si tratta
Lo scompenso cardiaco è una condizione clinica in cui il cuore non riesce a pompare una quantità di sangue adeguata alle necessità dell’organismo. Il numero dei soggetti affetti da questa patologia è in forte crescita, con conseguente ricaduta sul benessere dei pazienti stesso, dei loro familiari e sul sistema sanitario che cerca di prendersene cura in modo adeguato.
Molteplici sono le cause di scompenso cardiaco: infarto del miocardio, aritmie, patologie valvolari, patologie del muscolo cardiaco (cardiomiopatie), miocarditi, ma anche i vari fattori di rischio generali, come età, diabete mellito, ipertensione arteriosa sistemica possono concorrere col tempo al suo sviluppo.
Lo scompenso cardiaco è una condizione infatti molto variegata, che però si manifesta più o meno negli stessi modi: affanno, incapacità ad eseguire sforzi fisici più intensi, gonfiore alle gambe (edemi declivi), turgore delle vene giugulari, accumulo di liquidi a livello polmonare.

Armamentario contro lo scompenso cardiaco. Cosa abbiamo e cosa manca?
Molti progressi si sono fatti nella conoscenza dello scompenso cardiaco, tanto che se ne sono distinte diverse entità: scompenso a contrattilità (frazione d’eiezione) ridotta, scompenso a contrattilità intermedia, scompenso a contrattilità conservata.
Ma altrettanti sviluppi si sono avuti dal punto di vista terapeutico:
- Dal punto di vista farmacologico: si è passato dai classici ACE-inibitori, sartani, diuretici, betabloccanti, antialdosteronici, ai più recenti Entresto (Sacubitril-Valsartan), glifozine (farmaci usati per il diabete, ma che si sono dimostrati migliorare sintomi e sopravvivenza nei pazienti con scompenso), oltre che altri in via sperimentale (omecamtiv mecarbil, vericiguat)
- Dal punto di vista strumentale il defibrillatore è stata per anni un’arma essenziale nei pazienti con scompenso cardiaco, non dal punto di vista dei sintomi, quanto più della sopravvivenza, in quanto offre protezione dalla morte improvvisa aritmica, altamente probabile in pazienti con una contrattilità cardiaca severamente ridotta (frazione d’eiezione sotto il 35%).
Il defibrillatore endocavitario (quello con gli elettrocateteri all’interno del cuore) ha spesso capacità di agire anche da pacemaker, stimolando esso stesso il cuore dal ventricolo dx, qualora sia necessario, provocando però una contrazione dissinergica (non sincrona nei vari segmenti) e quindi meno efficacie a svuotare il cuore ad ogni contrazione.
La condizione di dissincronia si rileva molto spesso all’ECG con quello che viene chiamato “blocco di branca sinistro” o semplicemente con l’evidenza di complessi elettrici più slargati, caratteristiche presenti anche in cuori scompensati/dilatati non necessariamente stimolati. Per tale motivo si è pensato anche a dispositivi biventricolari (CRT), cioè con cateteri che non entrano solo nella parte dx del cuore, ma anche a sx (attraverso il seno coronarico), in modo tale da dare una stimolazione più sincrona ed efficace, con conseguente riduzione dei sintomi dello scompenso e miglioramento nel tempo della condizione cardiaca di base.
Tutte queste situazioni hanno però lasciato vari punti scoperti. Ancora poche certezze abbiamo infatti sulle terapia nello scompenso cardiaco con contrattilità preservata, e soprattutto le terapie elettriche riescono ad avere efficacia ed a ridurre i sintomi qualora ci sia la frazione d’eiezione sotto il 35% e le caratteristiche di dissincronia all’ECG. Per questo motivo molti pazienti rimangono tutt’ora senza un’adeguata risposta ai loro sintomi, senza trovarne un’efficace soluzione.
La CCM: una nuova speranza
Negli ultimi anni si sono fatte avanti nuove tecnologie, supportate inizialmente da esperimenti su animali, poi da studi sempre più ampi su persone con scompenso cardiaco. Stiamo parlando della Modulazione della Contrazione Cardiaca, o più semplicemente CCM (Cardiac Contraction Modulation). Questa nuova tecnologia ha lo scopo di migliorare la contrattilità cardiaca tramite l’erogazione di una piccola quantità di energia (impulso sottosoglia) a livello del setto cardiaco, vicino alle vie di conduzione, in modo tale da provocare quelle modifiche cellulari atte a far aumentare il calcio intracellulare, e di conseguenza la contrazione con un effetto che si propaga man mano alle cellule circostanti.
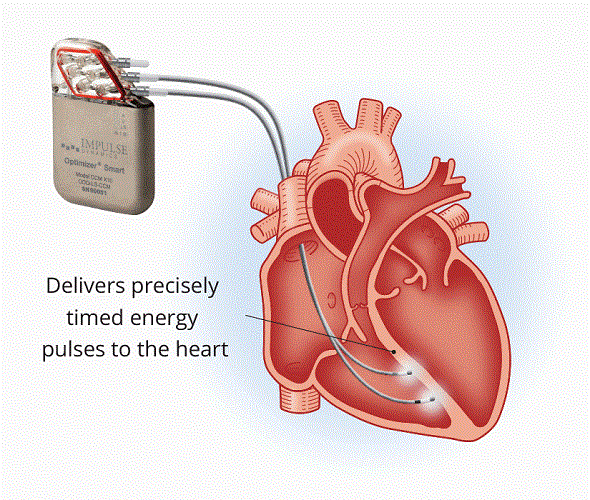
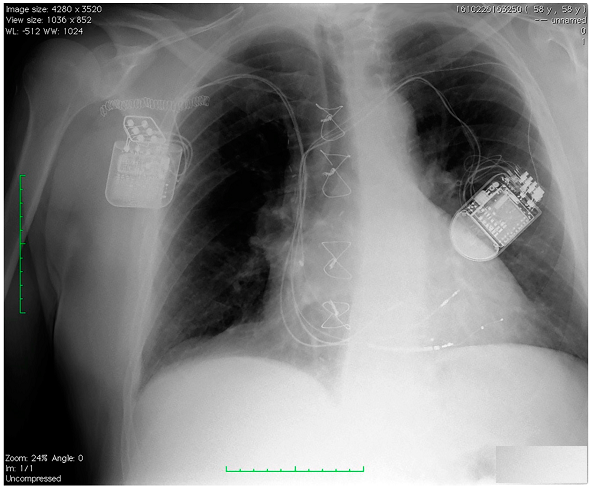
Il dispositivo creato per attuare questa tecnologia è l’Optimizer Smart, cioè un dispositivo simile ad un pacemaker, formato da un generatore/cassa collegato a due elettrocateteri che vanno sul setto interventricolare. Il dispositivo è posto in genere nella regione pettorale, subito al di sotto della clavicola (come accade per i pacemaker ed i defibrillatori), più frequentemente però viene posto a destra per la presenza di altri dispositivi a sinistra (pazienti con defibrillatore senza indicazione a dispositivi per risincronizzazione biventricolari o in cui questi non funzionano in maniera adeguata, oppure pazienti con scompenso cardiaco che hanno pacemaker ma non defibrillatore per la contrattilità non ridotta).
I due cateteri sentono le varie fasi del ciclo cardiaco e inviano il loro impulso nel periodo di refrattarietà assoluto, cioè quando nessuno stimolo può provocare contrazione o aritmie, in modo tale da dare solo l’azione benefica a livello cellulare. La sua frequenza massima per gli stimoli è di 90-110 battiti, inoltre è attivo in genere 7-12 h al giorno. Il dispositivo consuma molta più energia di un normale pacemaker, ma ha il vantaggio che si può caricare (in genere una volta a settimana) con una placca posizionata sulla cute per 40-60 minuti.
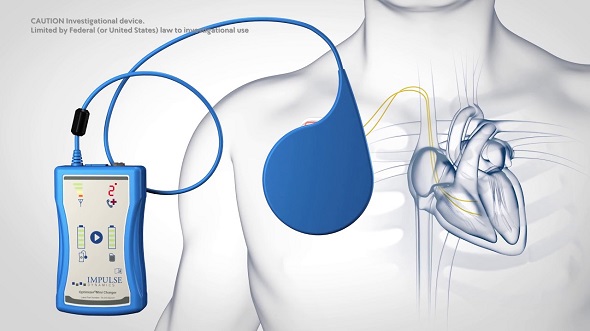
Gli studi sul dispositivo su pazienti affetti da scompenso cardiaco hanno dimostrato un miglioramento nella sintomatologia, nella quantità di metri percorsi (attraverso test dei 6 minuti), della qualità di vita, e nella prestazione sotto sforzo (valutata col test cardiopolmonare) nei pazienti con contrattilità (FE) tra il 25% ed il 45% con vantaggio massimo nei pazienti tra il 35% ed il 45%. Inoltre alcuni studi hanno dimostrato anche un miglioramento persino nella sopravvivenza e nella riduzione delle riospedalizzazioni per scompenso (FIX-HF5 e CCM-REG).
Il dispositivo Optimazer si è dimostrato quindi molto promettente, anche se ci sono pochi studi sull’efficacia nei pazienti con fibrillazione atriale, dimostrando una valida alternativa nei pazienti molto sintomatici con affanno, FE non severamente ridotta o in assenza di dissincronia accertata, coprendo anche la fascia con FE tra 35-45%, in genere non coperta o aiutata prima da altri dispositivi. Il dispositivo però non è una panacea e quindi non può essere usato quando la contrattilità è sotto questo range (<25%), quando il cuore è troppo dilatato (>70 mm), o quando è ad una frequenza cardiaca troppo alta.
La procedura di impianto
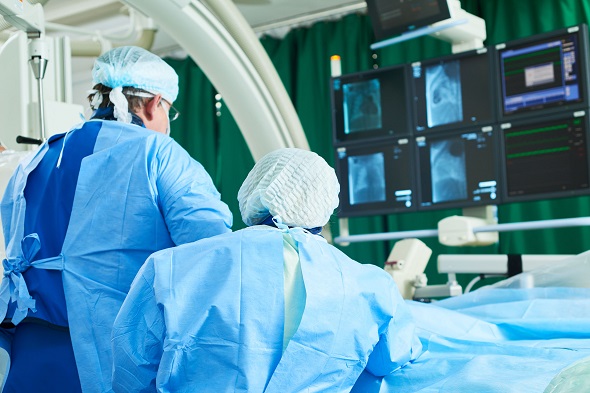
L’intervento è molto simile a quello di impianto di un pacemaker o di un defibrillatore. Infatti si tratta di un intervento di piccola chirurgia (in genere eseguito in anestesia locale) con cui il dispositivo viene posizionato in una piccola tasca sottocutanea sotto la clavicola. Il dispositivo viene collegato a due fili ( elettrocateteri) che attraverso un’applicazione transvenosa vengono inseriti all’interno di una grossa vena (la vena succlavia) e posizionati fino all’interno del cuore, precisamente a livello settale.L’intervento in tutto ha generalmente una durata di 30-60 minuti. L’impianto dell’Optimazer Smart in condizioni normali richiede una breve degenza (di 2-4 giorni, a seconda dei casi).
Possibili complicanze
Pur trattandosi di un intervento semplice e relativamente poco impegnativo per il paziente (un classico “intervento di routine”), c’è la possibilità di complicanze. Sono stati descritti infatti in letteratura alcuni casi di complicanze, spesso prive di significative conseguenze.
La complicanza più frequente è la dislocazione degli elettrocateteri che può rendere il dispositivo inefficace, ma che non ha conseguenze gravose sul paziente. Come ogni altra procedura di impianto, inoltre, c’è il rischio di pneumotorace, che si verifica quando viene accidentalmente punto il polmone con conseguente ingresso di aria all’interno dello spazio che circonda il polmone (spazio pleurico); oppure ematoma della tasca, cioè una raccolta di sangue all’interno della tasca, che può provocare un gonfiore nella sede di impianto del pacemaker. Il primo è risolvibile tramite il posizionamento di un drenaggio, mentre il secondo potrebbe richiedere un nuovo intervento per lo svuotamento (più frequente nei pazienti che assumono farmaci anticoagulanti o antiaggreganti, ma che si cerca di prevenire con adeguate correzioni della terapia pre- e post-impianto).
Aumentando il numero dei cateteri nel cuore vi è inoltre un teorico rischio di infezione della tasca del pacemaker che può diffondersi agli elettrocateteri. Cosa che è possibile anche se l’infezione parte dal dispositivo controlaterale. In genere l’infezione è una complicanza più frequente nei pazienti con alcune patologie croniche come il diabete mellito e l’insufficienza renale. Molto raramente può verificarsi un malfunzionamento del dispositivo o il dispositivo può risultare difettoso. In questi casi può rendersi necessario un nuovo intervento per sostituire il dispositivo malfunzionante con uno nuovo.
Le complicanze sono rese poco frequenti, grazie ad un’adeguata gestione del paziente, delle sue patologie di base e della sua terapia farmacologica.
Quando si intraprende un procedura di CCM, bisogna considerare l’impegno di entrambe le vene succlavie, cioè le vene che dal braccio portano il sangue venoso in atrio dx. La vena succlavia di sx è spesso impegnata ad accogliere i cateteri di un precedente pacemaker o defibrillatore, mentre la dx per i cateteri della CCM.
Ciò provoca raramente problemi al deflusso venoso, con rigonfiamento dell’arto, anche se è reso difficoltoso dalla grossa pervietà della vena rispetto ai cateteri, oltre che dal fatto che si osserva l’interno della vena con il contrasto prima della procedura, in modo tale da assicurarsi che la via da percorrere sia libera. L’utilizzo di entrambe le vie potrebbe rendere difficoltoso l’introduzione di accessi vascolari venosi avanzati in caso di necessità, quali il PICC (cateterino che dalla vena del braccio, arriva all’atrio dx, spesso usato per l’introduzione di farmaci che possono danneggiare una vena piccola al loro contatto, es. chemioterapici) o un accesso venoso centrale di tipo giugulare.
Un’altra causa di complicanze è legata ai limiti teorici dei dispositivi che vengono impiantati. Tutti i dispositivi progettati e costruiti dall’uomo possono infatti usurarsi col tempo, rompersi o risultare difettosi. Nonostante gli incredibili miglioramenti tecnologici che sono stati fatti negli anni, i moderni dispositivi elettronici cardiaci non sono indistruttibili e possono andare incontro a malfunzionamento.
Perché fare la CCM?
Nonostante si sia parlato prima di complicanze, bisogna considerare che anche il più semplice e banale intervento chirurgico ha piccole probabilità di averne . L’impianto di un CCM non fa eccezione a questa regola.
Talora le nuove tecnologie possono preoccupare, specialmente se hanno a che fare con il nostro cuore, forse l’organo più importante che noi abbiamo; ma non dobbiamo dimenticare i loro effetti benefici e la qualità di vita che esse possono offrirci, migliorando la “salute” del muscolo cardiaco. Bisogna inoltre considerare che tutte le equipe mediche impegnate in questo tipo di interventi, proprio perché particolarmente delicati, hanno le competenze e l’esperienza per prevenire, riconoscere e gestire al meglio queste complicanze, minimizzandone le conseguenze.
Nel nostro caso, la tecnologia di Modulazione della Contrattilità Cardiaca offre ai pazienti afflitti dalla sintomatologia di scompenso cardiaco un’occasione per un migliore benessere, sia fisico che psichico, e la possibilità di poter vivere più normalmente e con meno affanno. Infatti chi esegue un impianto di CCM ha miglioramenti della sintomatologia dopo 1 mese e col tempo si assiste anche ad un cambiamento vero e proprio del muscolo cardiaco (rimodellamento) con una parziale riduzione della dilatazione ed un miglioramento discreto della frazione d’eiezione.
Gli studi su biopsie animali dimostrano chiaramente che nel lungo periodo questa nuova tecnologia infatti riesce ad avere un impatto positivo, non solo sulla struttura cardiaca e la contrattilità, ma anche a livello microscopico con riduzione della fibrosi ed espressione di proteine del miocardio molto più performanti. Tutto ciò fa ben sperare per gli effetti a lungo termine della CCM nei nostri pazienti con scompenso cardiaco, quando ben selezionati.
Prospettive future

Tra le prospettive future per migliorare il funzionamento del dispositivo e ridurre le possibili complicanze si sta valutando di includere la funzione di defibrillatore, e quindi di creare elettrocateteri che riescano a svolgere sia la funzione di modulazione di contrattilità cardiaca, sia la funzione di defibrillatore per proteggere dalla morte aritmica.
In questo modo l’impianto diretto di un defibrillatore-CCM permetterebbe in unico intervento di ottenere sia benefici sullasintomatologia secondaria alla modulazione di contrattilità a breve e a lungo termine, sia sulla sicurezza per la sopravvivenza del paziente ad aritmie potenzialmente mortali. Tutto ciò sarebbe possibile con un solo impianto e con meno elettrocateteri, con quindi meno ingombro nelle vene, così come nelle camere cardiache.
Contatta l’esperto in merito a questo argomento.
Dott. Francesco Di Fraia
Medico in Formazione Specialistica in Malattie dell’Apparato Cardiovascolare
Università degli Studi della Campania “Luigi Vanvitelli”
Ospedale Monaldi – Napoli
Dott. Andrea Antonio Papa
Cardiologo Aritmologo, esperto in diagnosi e terapia dei disturbi del ritmo cardiaco
Dirigente Medico I livello
UOC Cardiologia e UTIC
Università della Campania L. Vanvitelli
AORN dei Colli – Ospedale Monaldi
Napoli